عندما كانت كارولين كاربر في العاشرة من عمرها شاهدت هطول المطر من السماء للمرة الأولى في حياتها. "كنت في درس القواعد، وبدأ المطر في الهطول. قلت في نفسي، يا إلهي، ما هذا؟ وقالت صديقتي، هذا هو المطر، ألم تر المطر من قبل؟ لقد كان كالعالم الجديد تماما بالنسبة لي".
ظهرت مشاكل الإبصار لدى كارولين بعد ولادتها بفترة قصيرة، لكن لم يدرك الأطباء أن هناك أمرا أخطر وراء ذلك إلا عندما ولد شقيقها الأصغر، كول، وهو يعاني ضعفا في الرؤية. في النهاية تم تشخيص حالة الطفلين بأنهما يعانيان عيبا خَلقيا في شبكية العين اسمه "كَمَه ليبر" LCA، وهو مرض وراثي نادر يصيب الشبكية، جعلهما يعانيان إعاقة شديدة في كلتا العينين. يقول كول: "كنت أقول للناس إنني نصف أعمى. فهذه في الواقع هي الطريقة الوحيدة التي تجعلهم يتفهمون حالتي".
قرر والداهما عدم إخبارهما بأن من الممكن أن يتطور المرض لدرجة أن يصابا بحالة العمى التام. تستذكر الأم آشلي: "شعرتُ بأنه لا جدوى من أن نحملهما عناء هذا الشعور في مثل ذلك العمر الصغير. إن كنت راشدا، ربما تكون قادرا على التعامل مع هذا الأمر - لكن حين تكون طفلا؟ أعتقد أنه عبء ثقيل فوق الحد. بيننا وبين أنفسنا، أحيانا، ربما تكون قلوبنا قد شعرت بالألم قليلا، لكننا لم نشعر مع الأسف قط من أجلهما".
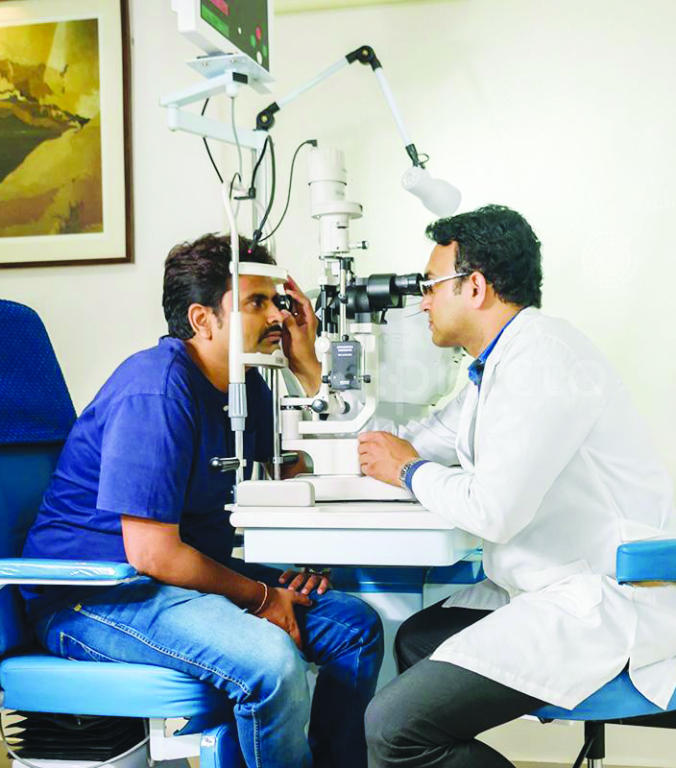
لا يظهر أي من هذا الحزن عندما أجتمع بالعائلة في منزلها في ليتل روك، ولاية آركنسو، في صباح يوم سبت رطب وحار. أثناء تناول كعك الشوكولاتة المصنوع في البيت والشاي المثلج، يخبرني كل من كارولين وكول كيف تلقيا علاجا رائدا يعرف باسم العلاج الجيني في تجربة سريرية في عام 2014، ما تسبب في استعادتهما لجزء كبير من قدرتهما على الإبصار. تفسر كارولين قائلة، قبل أن يقاطعها أخاها الذي من الواضح أنه شعر بالغضب لأنها تجنبت أن تذكر التفاصيل الدموية: "في الأساس، إنهم يأخذون الجين ويضعونه في العين". يتدخل الأخ قائلا بابتسامة عريضة: "أولا يخدرونك ثم يقومون بشق العين. ومن ثم يعطونك مصاصة. هذا الجزء هو الأفضل".
بإثارة كبيرة، يستذكر الأخوان الأسابيع والأشهر التي أعقبت العلاج، عندما أخذ كل منهما يرى الأشياء بشكل صحيح للمرة الأولى في حياته - الأسماك في الحوض، الشكل الدقيق لندفة الثلج، والسماء الصافية المليئة بالنجوم. كول الذي يبلغ من العمر الآن 11 عاما، لم يتمكن من السيطرة على إحساسه بالإثارة التي شعر بها عندما رأى قسم الألعاب في السوبرماركت، خاصة عندما فتش بين الرفوف ووجد لعبته المفضلة "بنادق نيرف" ـ كان يلعب ببندقية بينما كنا نتحدث.
كارولين التي ستبلغ 14 عاما في كانون الأول (يناير)، تتذكر رؤية نفسها في المرآة للمرة الأولى ولا تزال تنتفض رعبا من منظر النظارات الواقية القبيحة التي كانت تطلب منهما والدتها ارتداءها بعد إجراء العملية الجراحية. لكنها تشعر بالسعادة لأن رموشها - التي تم قصها استعدادا للعملية الجراحية - بدأت في النمو مرة أخرى بشكل كامل وأقوى بفضل الأدوية الستيرويدية التي تناولتها بعد العملية. تقول وهي ترتجف قليلا: "هذا العلاج جعلها تبدو جميلة، لذلك لا بأس في تناوله".
في وقت سابق من هذا الشهر، صوتت لجنة من العلماء والمختصين التي تقدم المشورة لإدارة الغذاء والدواء، بالإجماع لصالح الموافقة على العلاج الجيني المستخدم في حالة كارولين وكول، الذي يجري تطويره من قبل "سبارك ثيراباتيكس" Spark Therapeutics، وهي مجموعة للتكنولوجيا الحيوية مقرها فيلادلفيا. إذا أخذت الوكالة، كما هو متوقع، بالتوصيات في كانون الأول (يناير)، سيكون هذا الدواء هو أول علاج من هذا النوع يحصل على الضوء الأخضر في الولايات المتحدة.
يهدف منتج شركة سبارك، المسمى "لوكستيرنا"، إلى مساعدة مجموعة فرعية من المرضى المصابين بمرض "كَمَه ليبر"، من خلال علاج جيني يسمى "آر بي إي 65" RPE65 - يصل عددهم إلى نحو ستة آلاف مريض في أمريكا الشمالية وأوروبا وغيرهما من الأسواق المتقدمة الأخرى التي ترجو الشركة دخولها. لكن الموافقة على هذا العلاج ربما يكون لها آثار أوسع بالنسبة للطريقة التي نكافح بها العلل والأمراض.
ترميم العين
تهدف الأدوية إلى محاربة المرض من خلال مداهنة الجسم وفتح مسار بيولوجي واحد أو إغلاق مسار آخر. ويتخذ العلاج الجيني نهجا مختلفا، فهو يستبدل الحمض النووي المعيب أو المفقود، الذي يتسبب في المرض في المقام الأول، ويساعد الجسم في إصلاح نفسه. ولأنه يتعامل مع المرض ويتصدى له في جذوره البيولوجية، يمكن أن يقدم علاجا لمرة واحدة لمجموعة من الحالات من الأمراض الوراثية التي كان أمامها إما خيارات ضعيفة، وإما لا يوجد أي خيار للعلاج، بدءا من الهيموفيليا (الاستعداد للنزف) ومرض باركنسون، وصولا إلى مرض هنتينجتون، والتليف الكيسي وعدد لا يحصى من الأمراض النادرة. كما أنه يفتح المجال لإمكانية الحصول على ذلك الشيء الذي لا يزال عصيا على عالم الطب الحديث: الشفاء.
يشرح الطبيب مايكل سيدلاين، المختص في العلاج الجيني لدى مركز سلون كيترينج التذكاري لعلاج السرطان في نيويورك، قائلا: "العلاج الجيني يمنح الخلايا القدرة الجينية التي تحتاج إليها لمعالجة المرض والقضاء عليه بنفسها". ويضيف: "معظم الأدوية الحالية هي مواد كيماوية نأخذها على شكل حبوب أو بعض الطرق الأخرى لإدخال الأدوية إلى الجسم. وهي تكون فاعلة لبضع ساعات أو أحيانا لعدة أيام".
"لذلك هذا العلاج مهم ليس فقط للأشخاص الذين يعانون هذا النوع من العمى، ولكن لكثير من المرضى الآخرين. حين يكون لديك برهان من هذا القبيل، فإن هذا يشجع المزيد من العلماء والأطباء والصناعات على متابعة الأدوية العلاجية التي من هذا القبيل، وسيطالب المزيد من المرضى والمدافعين عنهم بوجودها. هذا ما يمكن إنتاجه بفعل نتيجة من هذا النوع".
العلاجات مثل الدواء الذي يجري تطويره من قبل "سبارك" هي تتويج لعقود من العمل في فرعين من فروع العلوم. أولا، مشروع الجينوم البشري الذي اختتم في عام 2003، وأمكن من خلاله فك السلسلة المكونة من ثلاثة مليارات حرف التي تشكل الشيفرة الجينية للإنسان، ما منح العلماء قائمة طويلة من الأهداف الخاصة بالعلاجات الجينية. ثانيا، توصل الباحثون إلى طريقة لنقل الجينات المستنسخة مباشرة إلى خلايا دون التسبب في فقدان جسم الإنسان لتوازنه.
على الرغم من أن هذا الحقل لا يزال في طور النشوء، هناك عدد من شركات التكنولوجيا الحيوية، إضافة إلى شركة سبارك، التي ترجو دخول العلاجات الجينية للأسواق خلال السنوات القليلة المقبلة، بما فيها "جينسايت" GenSigh العلاج يتم تطويره في باريس، الذي يستهدف نوعا مختلفا من أنواع فقدان البصر. شركات أخرى، مثل "بيومارين" BioMarin و"بلوبيرد بيو" Bluebird Bio، تعكف على تطوير علاجات لأمراض موروثة في الدم، في الوقت الذي تجري فيه شركة أفيكسيس AveXi تجارب تتعلق بمرض ضمور العضلات الشوكية، وهو هزال يصيب الأطفال. ويخضع هذا المجال لهيمنة شركات أصغر حجما ليست معروفة على نطاق واسع، لكن مجموعات صيدلانية كبيرة مثل "نوفارتيس" و"سانوفي" و"بريستول-مايرز سكويب" و"فايزر" استثمرت مليارات الدولارات في العلاج الجيني في السنوات الأخيرة.
تقول الطبيبة سينثيا دنبار، الباحثة في المعهد الوطني للدم والرئتين والقلب: "هناك عدد من الأشخاص الداعمين لشركة سبارك، لذلك حقيقة أن إدارة الغذاء والدواء تؤمن بصحة بيانات السلامة والكفاءة طويلة الأجل تعد أمرا مشجعا للغاية".
وعلى الرغم من أن هناك كثيرا من التساؤلات العلمية التي لم يتم الإجابة عليها بعد، تخشى دنبار وآخرون من أن القدرة على تحمل التكاليف هي أكبر العوائق التي تواجه الاعتماد واسع النطاق لتلك العلاجات الجينية. ولم يتم تأسيس أنظمة الرعاية الصحية لتدفع ثمن العلاجات التي تؤخذ لمرة واحدة التي من المتوقع أن تبلغ تكلفتها أكثر من مليون دولار لكل مريض في كثير من الحالات المرضية. تقول أيضا: "المشكلة ستكون في تحديد آلية لهيكلة المدفوعات مقابل الحصول على علاج مكلف جدا لمرة واحدة فقط"، مضيفة أنه في الوقت الذي يمكن أن تخفض فيه العلاجات الجينية الإنفاق على الرعاية الصحية على المدى البعيد، لن نشعر بالوفورات إلا بعد مضي وقت طويل.
كارولين وكول
لم يكتمل شفاء كارولين وكول، لأن بعض خلايا الشبكية لديهما كانت قد ماتت بالفعل قبل أن يبدأ العلاج وتعذر إنقاذها. وتطلب كارولين من معلمة العلوم في مدرستها أن ترسل لها الواجبات مسبقا، لأنها لا تستطيع الرؤية في الظلام. كول الذي يطمح إلى أن يصبح لاعب جولف، يجد صعوبة أثناء ملاحقة الكرة، ولا يزال يعاني حركة غير إرادية في العين تعرف بـ "الرأرأة" (تذبذب المقلتين السريع اللا إرادي). لكن عند سماعهما يسردان قصتهما تشعر كم تغيرت الأمور تماما. كيف هربا، بحسب كلمات كارولين، من "عالم مظلم مليء بالخطوط والظلال".
في وقت لاحق، وبينما يلعب أولادها بالأرجوحة الموجودة في الحديقة الخارجية، تعيد آشلي سرد قصة سعيها للعثور على شيء يمكنه مساعدتهما في استرداد بصرهما. غير هيابة من سوء التشخيص، سرعان ما جعلت نفسها تتأقلم مع النشرات الطبية وبدأت بحضور اجتماعات مخصصة للحديث حول الأمراض التي تصيب الشبكية أملا في إيجاد فرصة لهما للمشاركة في إحدى التجارب. وبإيمان عميق، تتلمس مساعدة الله لها. تقول: "إيماني قوي جدا، وعندما أتذكر ما حصل، أرى أن كل شيء كان مقدَّرا. أنا لا أقدم مواعظ لكنني أعتقد حقا أن الله منحهما شيئا ما. أنا لا أؤمن بالصدف. بل أعتقد أن كل شيء يحدث لسبب".
أيا كان السبب، كان هناك شخص مبتسم في عائلة كاربر. في عام 2006، بعد وقت قصير من تشخيص إصابة الطفلين بالمرض، وجدت آشلي نفسها في مؤتمر طبي تجلس بالقرب من الطبيبة، جين بينيت، العالمة في جامعة بنسلفانيا والمتخصصة في علم وراثة ضمور الشبكية. آشلي لم تكن تعرفها في ذلك الوقت، لكن بينيت كانت تعمل بالفعل على إنتاج هذا العلاج الذي من شأنه أن يغير حياة كل من كارولين وكول.
بدأت بينيت وزوجها، آلبرت ماجواير، جراح العيون الذي يعمل أيضا ضمن طاقم موظفي جامعة بنسلفانيا، في تطوير العلاج الذي تم إعطاؤه لطفلي عائلة كاربر في التسعينيات، قبل فترة طويلة من تحديد الجين المسؤول، "آر بي إي 65"، من قبل مشروع الجينوم البشري. علم الاثنان أن العين هي مرشح جيد لهذا العلاج الجيني لأن فيها درجة عالية ما يسميه العلماء ميزة الحصانة. لكي يتم إدخال الجينات في الجسم، تحتاج بينيت إلى تحزيم الحمض النووي المستنسخ داخل أداة تسليم يمكنها حمله ونقله إلى الخلايا المستهدفة. وكان أحد الخيارات هو استخدام فيروس معدل، ذلك الكائن صغير الحجم والمعروف بقدرته على اختراق البشر، لكنه كان خيارا محفوفا بالمخاطر.
عندما يتم إدخال فيروس أو أي مادة بيولوجية غريبة أخرى مباشرة إلى الجسم، يحاول جهاز المناعة في جسمنا تدمير ما يعتبره أحد الغزاة. في أفضل السيناريوهات يجري تدمير الفيروس، ما يجعل التدخل غير مجد. في بعض الحالات يمكن أن تكون الاستجابة عنيفة جدا بحيث يتبين أنها مُهلِكة.
لكن العين هي نظام مغلق يحصل على التعادل البيولوجي المتمثل في المرور الحر من قبل جهاز المناعة في الجسم، ما يعني أنه يجري تقليل الخطر بشكل كبير. كما أنها واحدة من أصغر الأجهزة في الجسم، لذلك لا يلزم بينيت إنتاج كميات كبيرة من علاجها الجيني التجريبي لإجراء التجارب.
تستذكر قائلة: "تبدو العين وكأنها هدف رائع لأسباب كثيرة، لذلك بدأنا تطوير الخبرة الجراحية للحصول على الجينات. ومن ثم تطور المجال وتم تحديد الجينات. بحلول عام 2000 كان لدينا أنموذج جيد، حصلنا على فيروس جيد، وكنا نعرف آلية الحصول عليه. ولم نقتنع بالأمر حتى نجح أنموذج الكلب: عين الكلب بمثل حجم عين الإنسان".
سنوات مظلمة
قد تكون الخطوة المنطقية التالية بعد سنوات عديدة من التجارب التي أجريت على الكلاب، هي البدء في دراسة العلاج المقدم لمتطوعين من البشر، لكن حقل العلاج الجيني عانى انتكاسة اعتقد كثيرون أنه لن يتعافى منها أبدا. في أيلول (سبتمبر) 1999، توفي جيسي جيلسينجر، وهو صبي يبلغ من العمر 18 عاما كان يعاني مرضا في الكبد، بعد أربعة أيام من إعطائه علاجا جينيا تجريبيا خلال تجربة علاج سريرية. وكان قد عانى استجابة مناعية مميتة ضد الفيروس المستخدم في إدخال المادة الجينية إلى جسمه. وتعرض الباحثون المسؤولون عن الدراسة، الذين هم أيضا أساتذة في جامعة بنسلفانيا، لانتقادات حادة من قبل إدارة الغذاء والدواء.
تستذكر بينيت قائلة: "تماما في الوقت الذي كنا نشهد فيه تحقيق أول نجاحات لنا، تعرض حقل العلاج الجيني لضربة هائلة. تم سحب كل التمويل المقدم له وتم فرض قيود ولوائح. اعترضت الريح أشرعة سفننا. كان من الصعب جدا العثور على دعم لتجاربنا، ولا حتى دعم لتجارب علاجات الأطفال، الذين نعلم أنهم قد يكونوا المستفيدين في النهاية".
مرت خمس سنوات قاتمة إلى أن ظهرت بارقة أمل تمثلت في الطبيبة كاترين هاي، صديقة وزميلة الطبيبة بينيت، التي كانت تعمل في ذلك الوقت باحثة في مستشفى الأطفال في فيلادلفيا، الذي تربطه علاقات قوية جدا مع جامعة بنسلفانيا. تقول بينيت: "دخلَتْ إلى مكتبي في يوم من أيام شهر تموز (يوليو) وقالت: ’جين، هل ترغبين في إجراء تجربة سريرية؟‘". كان الأمر مثيرا جدا. اضطررت أن أقرص نفسي حتى أتأكد أنني لست أحلم وأن هذا حقيقة. واستغرقني الامر أقل من ثانية لأوافق. لم يكن هذا المسار مطروقا من قبل - كان علينا أن نبنيه بأنفسنا". التقيت بالدكتورة هاي في وقت لاحق في مكتبها في الطابق 13 من إحدى ناطحات السحاب المطلة على أفق فيلادلفيا. تنظر إلي من خلف نظارات ذات إطار فضي نظرة شخص يعطي الانطباع بأنه دائما ما يكون مبتسما. بعد أن أصبحت طبيبة متخصصة في مرض الهيموفيليا من خلال التدريب، بدأت العمل في أواخر الثمانينيات على علاج جيني لهذا المرض الوراثي الذي يوقف الدم من التخثر بالشكل السليم. وكانت عازمة على إيجاد بديل للحقن وعمليات نقل الدم التي يجب على المصابين تحملها، جزئيا بسبب أزمة الدم التاريخية التي كانت تعني أن بعض مرضاها أصيبوا بمرض نقص المناعة البشرية "الإيدز". لكن بعد وفاة جيلسينجر انسحبت شركة الأدوية الصيدلانية التي كانت تعمل معها، تاركة إياها من دون مصدر تحصل من خلاله على فيروس مناسب للبحوث الطبية لتكملة دراساتها.
تعترف بأسلوبها المتشدق الجنوبي إلى حد ما قائلة: "عندما تعمل في مجال كهذا، لا يمكنك تقريبا رؤية كل الأشياء التي تدور من حولك. علي أن أعترف أنني عانيت تلك المسألة". عندما أدركت في النهاية أن ذلك المجال واقع في المتاعب، بدأت في محاولة اجتذاب دعم جديد لبحوث العلاج الجيني، بحيث التجأت أخيرا إلى مستشفى الأطفال في فيلادلفيا. "عندما تتوتر الأمور أمامي بشكل كبير، أركز على الأمور اللوجستية. هناك قول عظيم لجنرال أمريكي خلال الحرب العالمية الثانية، عمر برادلي، قال فيه: "الهواة يتكلمون حول الاستراتيجيات، أما المحترفون فيتكلمون حول الأمور اللوجستية".
أقنعت هاي المستشفى بأن ينشئ وحدة متخصصة في العلاج الجيني، لكن الموافقة جاءت مع تحذير مهم: يتعين على القسم العمل ليس فقط لعلاج مرض الهيموفيليا، بل لعلاج مرض يؤثر أساسا في الأطفال. وهذا شجعها لتوظيف بينيت.
بحلول شباط (فبراير) 2011، بعد أن نشر فريق هاي في المجلات الأكاديمية نتائج التجارب البشرية الأولى التي أجريت، بدأ العالم الخارجي في ملاحظة النجاحات التي كانتا تحققانها. بدأ مستثمرو التكنولوجيا الحيوية الاتصال بهاي، وأخذوا يسألون إن كان بإمكانهم تمويل جهود المستشفى مقابل الحصول على حصة. لكنها كانت مشغولة جدا لدرجة أنها لم تستطع التحدث معهم. "كنت أقول لهم دائما: رجاء، اتركوني لوحدي".
نقطة تحول
ثمة شخص آخر لم يكن ليتركها وشأنها، وهو جيفري مارازو، وهو شاب يعمل في الاستشارات الإدارية كان يعمل لدى المستشفى في مجال اكتشاف طرق لتحقيق المزيد من الإيرادات. "كنت دائما ما ألغي موعدي معه. كل يوم أنظر إلى جدول أعمالي وأسأل مساعدي: من هو هذا الشخص؟ ثم أقول: لا، لا يمكنني مقابلته". في النهاية، رضخت للأمر الواقع، وعقدت مع مارازو اجتماعا كان الوقت المحدد له 45 دقيقة. بعد مضي ثلاث ساعات، كانا لا يزالان يتكلمان حول إمكانات العلاج الجيني. ومن ثم عاد مرة أخرى إلى الرئيس التنفيذي للمستشفى لتبليغه بأفكاره، محتفظا بالأفكار الأفضل حتى النهاية. ثم قال لها: "هل تعرفين هؤلاء الناس الموجودين في الطابق الخامس؟ إنها شركة لصناعة الدواء. ويجدر بك التعاون معهم".
صمم مارازو عملية لفصل شركة سبارك لتصبح شركة مستقلة في عام 2013، وقبل عامين أنهت المجموعة عملية اكتتاب عام أولي، مدرجة أسهمها ضمن مؤشر ناسداك تحت الرمز ONCE - وهي إشارة إلى الخصائص الشفائية المحتملة للعلاج الجيني. منذ ذلك الحين تركت هاي عملها في مستشفى الأطفال في فيلادلفيا وانضمت لشركة سبارك لتعمل رئيسة للشركة ورئيسة الأبحاث والتطوير.
اليوم تبلغ قيمة الشركة ثلاثة مليارات دولار، على الرغم من أن معظم هذه القيمة لا تعزى إلى علاج العمى الذي تنتجه، بل إلى برامج الهيموفيليا في المراحل المبكرة، التي ستثبت أنها مربحة للغاية فيما لو نجحت: هناك ما يقارب 190 ألفا من المصابين بالمرض في كل أنحاء العالم. وسارع مستثمرو وول ستريت لاقتناص الأسهم هذا العام، ما أدى إلى ارتفاع أسعارها ما يقارب 70 في المائة، ويعود ذلك في جزء كبير منه إلى البيانات التي تبشر بالخير والتي نتجت عن تجارب مرض الهيموفيليا.
يمضي مارازو الكثير من وقته في التفكير في الطريقة التي سيدفع من خلالها العالم تكلفة العلاجات الجينية. لأنه في الوقت الذي سيكون فيه "لوكستيرنا" بمنزلة فتح كبير، إن تمت الموافقة عليه في كانون الثاني (يناير)، سيحتل عناوين الصحف باعتباره واحدا من أغلى الادوية ثمنا على الإطلاق. ولم تعلن "سبارك" بعد عن السعر، لكن الرقم الذي يجري تداوله بصورة هامسة بين العلماء العاملين في هذا المجال يراوح بين 700 ألف و900 ألف دولار للعين الواحدة، الأمر الذي من شأنه أن يجعل التكلفة الإجمالية لعلاج مريض واحد تفوق كثيرا المليون دولار.
والحقيقة التي مفادها أن العلاجات مثل لوكستيرنا يُقصَد بها أن تُعطى لمرة واحدة فقط تعني أن الشركات التي تنتجها لا يمكنها استرداد استثماراتها بالطريقة المتعاقبة التي يجري استخدامها من قبل شركات تصنيع الأدوية التقليدية، التي تنتج الدواء أو الحقن التي يتم وصفها وشراؤها على أساس منتظم. بالنسبة لأحد الأمراض النادرة، مثل المرض الذي يعانيه الطفلان كاربر، ربما لا يكون للأمر أهمية كبيرة: يغلب على أنظمة الرعاية الصحية أن تنظر إلى تكلفة العلاج بصورة جماعية وليس بحسب كل شخص على حدة، ويتوقع المحللون أن هذا المنتَج سيولد فقط 120 مليون دولار من المبيعات في عام 2018.